
 | |
|
|
Главная » Книги и журналы 1 ... 23 24 25 26 27 28 29 ... 32 А. Параметры элементов и батарей Электрохимические элементы и батареи, составленные из них по параллельно-последовательным схемам соединений, характеризуются следующими основными параметрами и эксплуатационными свойствами. Электродвижущая сила элемента измеряется при разомкнутой внешней цепи, определяется химическими свойствами активных материалов: электродов и электролита. Форма и размеры электродов на величину э. д. с. не влияют. нутреннее сопротивление элемента определяется суммарным сопротивлением электродов, электролита и деполяризатора, зависит от рабочей поверхности электродов, их материалов, плотности электролита и его температуры. Величина внутреннего сопротивления определяется из соотношения (9-2) где / и Un - ток и напряжение на нагрузке; Ru - внутреннее сопротивление элемента постоянному току. Очевидно, что внутреннее сопротивление элемента или батареи характеризует способность к перегрузке и определяет величину нормального разрядного тока, при котором можно получить максимум электрической энергии. Емкость элемента определяется количеством электричества, отдаваемого элементом при разрядке: (9-3) о где I - время разрядки. При разрядке элемента постоянным по величине током / емкость Q - IJa-ч. (9-4 G изменением условий разрядки меняется емкость элемента. Обычно оговаривается время непрерывной разрядки (10 20 ч и т. д.), при котором элемент, обладает номинальной емкостью. Саморазряд элемента понимается как уменьшение емкости за счет разрядки элемента при незамкнутой его внешней цепи на полезную нагрузку. Сам же по себе процесс саморазряда происходит независимо от того, нагружен или не нагружен элемент. Саморазряд элемента может происходить как за счет низкого качества изоляции между электродами, так и, главным образом, за счет побочного электрохимического процесса внутри элемента, приводящего к бесполезной трате отрицательного электрода и деполяризатора. Интенсивность саморазряда зависит от содержания примесей в активных веществах электродов и температуры электролита. .,иапазон рабочих, , элемента пред- определяет возможности использовании с^гих элементов при различных температурах окружающей среды. При температурах, близких к температуре замерзания электролита, э. д. с. элемента резко уменьшается. После отогревания электролита действие элемента возобновляется. Для повышения холодостойкости элемента используют специальные электролиты: со специальными примесями или в виде пасты. Такие электролиты не замерзают даже при очень низких температурах. Таким образом, электролит предопределяет нижнюю рабочую температуру элемента. Верхний предел рабочих температур элемента определяется материалами электродов, допустимой интенсивностью саморазряда и предельными значениями изменения внутреннего сопротивления. Удельные характеристики элементов обычно даются по весу (вт/кг, вт -ч/кг и а -ч1кг) или по объему (вт/дм, вт ч/дм или а ч/дм). Иногда вместо объема в дм указываются литры. При определении величин мощности, энергии или емкости элемента исходят из номинальных величин тока, напряжения и емкости описываемых элементов. устойчивость к ударным и вибрационным нагрузкам обычно указывается для элементов, используемых в передвижных радиоустройствах (самолетных, ракетных и др.). Для этого элементы проходят испытания на вибрационных установках с заданной частотой и амплитудой вибрации или ударной нагрузки. Устойчивость элементов к ударным и -вибрационным нагрузкам оценивается их способностью выдерживать ускорение определенной величины. При этом величина ускорения соизмеряется с ускорением свободно падающего тела g. Большинство сухих элементов, например, выдерживают ускорения до 25 g. Б. Типы элементов и батарей Все элементы и батареи можно классифицировать по системам, определяющим материал электродов и деполяризатора. Могут быть также дополнительные отличительные признаки, характеризующие конструкцию, технологию производства и эксплуатационные особенности. По системам различают элементы следующих типов. 1. Угольно-марганцево-цинковые. Они наиболее широко распространены, имеют различные конструкции (рис. 9-1, б)у но принято считать их устаревшими, поскольку удельная энергия невелика, разрядная характеристика имеет падающий характер, а устойчивость к ударным нагрузкам недостаточная. Несколько лучшие параметры у элементов и батарей этой системы, изготовленных методом набивной технологии, у которых электроды сближены, увеличено количество активных материалов без изменения габаритов, снижено внутреннее сопротивление. 2. Цйнково-двуокись марганцевые с солевым электролитом (МЦ), малогабаритные, герметизированные, изготовленные методом набивной технологии. 3. Малогабаритные воздушно-цинковой (ВЦ) имарганцево-цинковой (МЦ) систем со щелочным электролитом, обладающие повышенными значениями параметров и улучшенными эксплуатационными свойствами. 4. Окиснортутные (ОР). Из них получили наибольшее распространение окиснортутные с цинковыми анодами, обладающие большим постоянством э. д. с. в течение весьма длительного времени. Эти элементы герметизированы. 5. Индиево-ртутные, миниатюрные, обладающие большим постоянством э. д. с. и пологой разрядной характеристикой в широком диапазоне рабочих температур (- 40 до + 70° С). 6. Ртутно-цинковые, малогабаритные, применяемые для электропитания миниатюрной радиоэлектронной аппаратуры. 7. Медноокисные большой мощности, стационарного типа, обладающие высокой удельной энергией и очень длительным сроком службы (10-15 лет). 8. Серебряноокисные пуговичной конструкции с высокой удельной энергией (до 110 em ч1кг). Имеется также целый ряд новых типов элементов специальной конструкции и специфического назначения. К ним можно отнести следующие. 1. Ленточные электрохимические батареи, в которых расходование активных веществ осуществляется лишь по мере надобности. Их действие начинается лишь с того момента времени, когда под воздействием управляющего сигнала приводится в действие механизм перематывания ленты и в процессе движения ленты активные вещества смачиваются электролитом. Для этого жидкий электролит заключен в микрокапсюли, которые разрушаются при перематывании ленты. 2. Серебряно-цинковые, наливные, резервного действия. В них электролит находится в отдельном резервуаре и управление заливкой электролита осуществляется по радиосигналу на расстоянии. 3. Мощные элементы с воздушной депо- л я р и 3 а ц и е й типов ВДЛ, ВДЦ и ВДЖ. Они отличаются §: от обычных элементов большой емкостью и хорошими эксплуата-Р ционными свойствами, имеют сменные электроды. § 9-3. АККУМУЛЯТОРЫ 1,ействие аккумуляторов, как и гальванических элементов, основано на обмене электронов между материалами электродов при активном участии электролита. Поэтому аккумуляторы классифицируются по виду электролита (кислотные, щелочные), по материалу электродов (свинцовые, кадмиево-нике- левые, серебряно-цинковые и др.) по конструкции (ламельные, без ламель ные, герметизированные и др.). В аккумуляторах осуществляются окислительно-восстановительные процессы при замкнутой их внешней цепи. При зарядке аккумуляторов в процессе электролиза на положительном электроде протекает реакция окисления, а на отрицательном электроде - реакция восстановления. При разрядке аккумуляторов реакции протекают в обратном порядке: на положительном электроде идет реакция восстановления, а на отрицательном - реакция окисе^е-ния. Окислительно-восстановительные процессы в аккумуляторах обратимы, благодаря чему возможны многократные циклы заряд-разряд аккумулятора. В качестве примера обратимости окислительно-восстановительных процессов могут служить процессы в кислотном свинцовом аккумуляторе. Положительный электрод кислотного аккумулятора состоит из свинцовых пластин, покрытых слоем двуокиси свинца РЬО<>; отрицательный электрод состоит из чистого свинца, находящегося в сильно раздробленном состоянии (так называемый губчатый свинец). Оба электрода помещены в сосуд заполненный электролитом - раствором серной кислоты в дистиллированной воде. В результате взаимодействия серной кислоты с окислами свинца на электродах образуется тонкий слой сернокислого свинца (сульфат свннца). В процессе зарядки аккумулятора, когда его подключают к источнику постоянного тока и в аккумуляторе начинается окислительно-восстановительный процесс, сернокислый свинец на положительных пластинах превращается в двуокись свинца, а на отрицательных пластинах - в свинец. В процессе разрядки аккумулятора, когда в его внешней цепи включена нагрузка, двуокись свинца положительных пластин, взаимодействуя с серной кислотой, восстанавливается в металлический свинец. Химические реакции при зарядке и разрядке протекают согласно с сравнением РЬОа + 2H2SO4 + РЬ PbSO - 2HsO+PbSO (9-5) где левая часть уравнения характеризует заряженные, а правая часть - разряженные пластины. Одновременно с изменением состава электродов аккумулятора изменяется и концентрация серной кислоты, а именно: при зарядке она повышается, а при разрядке понижается Описанные электрохимические процессы протекают одинаково в кислотных аккумуляторах всех типов, несмотря на их некоторые конструктивные различия. Разумеется, что эти процессы протекают также и в аккумуляторных батареях, составленных из определенного количества единичных аккумуляторов. Типовая конструкция кислотных аккумуляторов такая, что все отрицательные и положительные пластины аккумулятора монтируются в блоки, расположенные в сосуде с электролитом так, чтобы в промежутки между отрицательными пластинами входили положительные пластины, число которых на одну пластину меньше числа отрицательных пластин. Для предохранения пластин от замыкания между ними помещены изолирующие прокладки. Вид маломощной аккумуляторной батареи из свинцовых аккумуляторов показан на рис. 9-2, а. Номинальное напряжение единичного кислотного аккумулятора равно 2,0 е\ при зарядке напряжение на аккумуляторе доводится до 2,6-2,8 е\ в начале разрядки напряжение быстро снижается до \ xw разряжать аккумулятор / .1 Лщ ниже 1,8 в не допускается. Щелочные кад-миево - никелевые ламельные (КН) аккумуляторы монтируются из тонких пластин никелированной стали. В зависимости от типа электрода (положительного или отрицательного) на пластины напрессовываются брикеты различной активной массы (ламели). Брикеты ак- 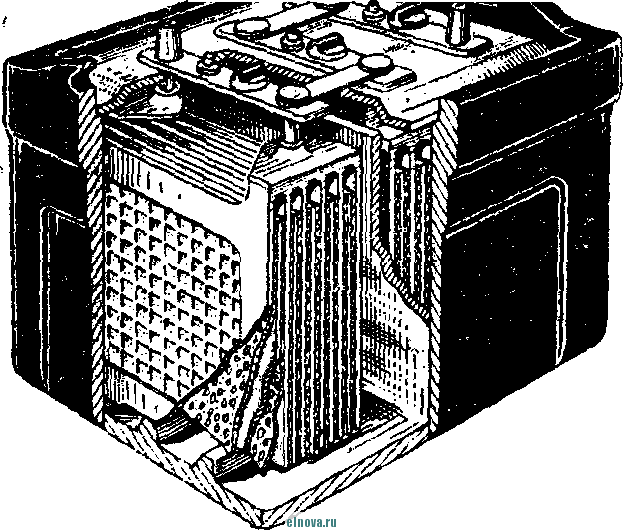  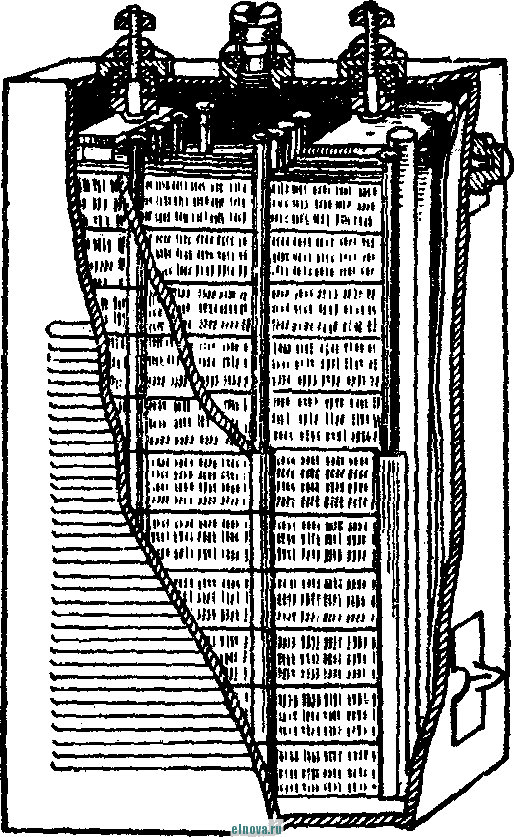 Рис. 9-2. Кислотный и щелочной аккумуляторы- тивной массы помещены в перфорированные стальные оболочки, причем пластины сварены между собой так, чтобы между соседними пластинами имелся зазор для доступа электролита к активной массе. Чтобы предохранить пластины от плотного прилегания одной к другой, между ними помещаются изолирующие прокладки (сепараторы). Активная масса положительных пластин состоит из гидрата окиси никеля Ni (ОН)з, который для повышения электрической проводимости смешан с графитом. Активная масса отрицательных пла- стин содержит кадмии и железо. ...улятора сопрово- ждается частичным раскислением Ni (ОН)з и окислением железа и кадмия, а при зарядке - процессы протекают в обратном порядке. Размеры и число пластин каждого аккумулятора определяется необходимой емкостью, причем число положительных пластин всегда на одну больше, чем отрицательных пластин. Внешний вид одной из КН-аккумуляторных батарей в собранном виде показан на рис. 9-2, б. Электролитом КН-аккумуляторов служит водный раствор едкого кали плотностью 1,21. В химических реакциях электролит активно не участвует и поэтому его концентрация в процессе использования аккумулятора почти не меняется. Во время зарядки напряжение на аккумуляторе быстро повышается до 1,45 в, долго остается почти неизменным и в конце зарядки достигает 1,75-1,8 е. При разрядке аккумулятора напряжение составляет в среднем 1,2 е. Нижний предел напряжения при разрядке зависит от длительности разрядки: при 8-часовом разряде конечное напряжение составляет 1,1 в; ниже 0,5 в аккумулятор разряжать нельзя из-за быстрого разрушения брикетов активной массы. Кадмиево-иикелев ы.е безламельные (КБН) аккумуляторы отличаются отсутствием в них ламелей. Пластины изготовлены напрессовкой порошкообразной активной массы на стальную рамку с последующей формовкой, в процессе которой им придают необходимую пористость и прочность. В таких аккумуляторах площадь соприкосновения активной массы с электролитом больше, чем у ламельных. В результате удельная мощность больше, чем у ламельных, внутренцее сопротивление меньше; механическая прочность и долговечность меньше, чем у КН-аккумуляторов. В современных КБН-аккумуляторах использована новая конструкция и материалы высокого качества, благодаря чему снижен эффект саморазряда, почти устранены случайные короткие замыкания пластин и увеличен срок службы до 200 зарядно-разрядных циклов. Кадмиево-никелевые с пористыми пластинами аккумуляторы по своей конструкции сходны с КН-ак-кумуляторами. Различаются они лишь по технологии изготовления. Благодаря большой пористости и соприкосновения активной массы с электролитом их внутреннее сопротивление приблизительно в 10-15 раз меньше, чем у КН-аккумуляторов. Это дает возможность широко использовать их при импульсном характере нагрузки. У единичного аккумулятора с электролитом из раствора углекислого кали э. д. с. составляет l,65i в. Малогабаритные герметизированные кадмиево-никелевые аккумуляторы обладают способностью заряжаться длительное время при малых зарядных токах с малым выделением газов, частично поглощаемого материалом электродов и электролита. С целью снижения количества выделяемого газа при их зарядке напряжение не должно превышать 1,5 в. По конструкции различаются аккумуляторы дисковой, цилиндрической и пуговичной формы. Внешний вид этих аккумуляторов показан на рис. 9-3. Среднее разрядное напряжение герметизированных аккумуляторов составляет 1,22-1,25 в, которое при импульсном режиме разрядки снижается до 1,1 в. Емкость аккумуляторов снижается по мере понижения температуры электролита. Железо-никелевые (ЖН) аккумуляторы отличаются от КН-аккумуляторов тем, что крайними у них являются не положительные, а отрицательные пластины (отрицательных пластин на 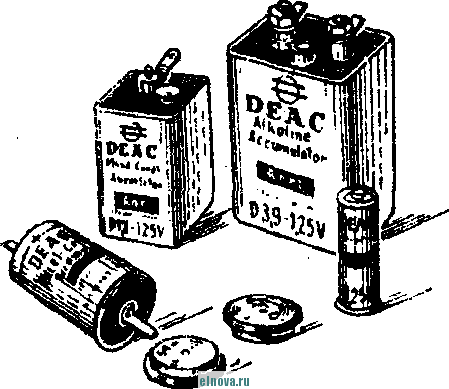 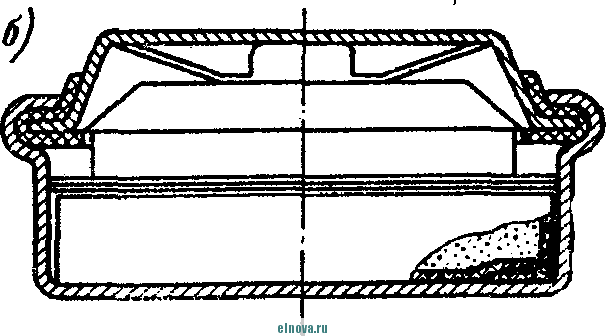 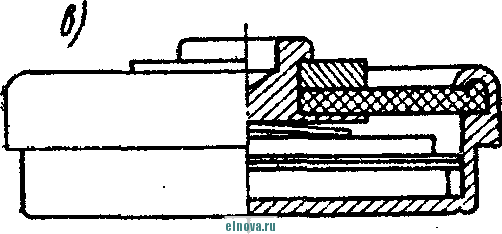 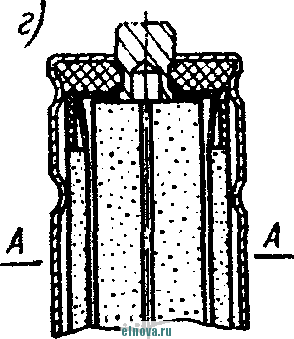 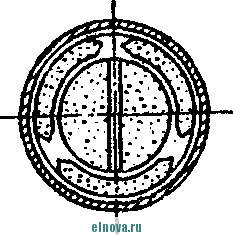 - р н J - Рис. Я-3< Малогабаритные гер1метизированные кадмиево-никелевьдае аккумуляторы: а - внешний вид; бив - схематическое устрой- ство дисковых аккумуляторов; г схематическое устройство ци- линдрического аккумулятора -- I г- I У* h и одну больше, чем положительных). Это обусловлено тем, что объем активной массы положительных пластин больше объема отрицательных пластин. Активная масса положительных пластин состоит из гидрата закиси никеля Ni(OH)2, смешанного с графитом. Исходным материалом для приготовления активной массы служит сернокислый никель и едкий натрий. Массу отрицательных пластин приготовляют из порошкообразного железа, исходным сырьем которого служит семиводный сульфат железа. Химические реакции при зарядке и разрядке ЖН-аккумуляторов в упрощенном виде описываются уравнениями: 2Ni(OH)2 ~ 2е + 20Н'==2№(ОН)з- для положительных пластин; Fe(OH)2 + 2е Fe + 20Н' - для отрицательных пластин. (9-6) В этих уравнениях е ион гидроксила. заряд электрона, ОН отрицательный Электролитом ЖН-аккумуля1. д.аствор едкого кали с добавлением гидрата окиси лития. Такой электролит сохраняет свою активность в течение 750 зарядно-разрядных циклов. Зарядно-разрядные характеристики ЖН- и КН-аккумуляторов почти одинаковые. Разряжать ЖН-аккумуляторы до напряжения менее 0,5 в нельзя. Их можно подзаряжать малыми токами, что предопределяет возможность их эксплуатации в буферном режиме. Серебряно-цинковые (СЦ) аккумуляторы по своему устройству аналогичны безламельным кадмиево-никелевым. Материалом . для положительных пластин служит восстановленная окись серебра, для отрицательных пластин - смесь окиси цинка с цинковым порошком. Пластины обладают большой пористостью и обеспечивают хороший доступ электролита. Электролитом служит раствор едкого кали. Химические процессы при зарядке и разрядке СЦ-аккумулято-ров описываются уравнениями; - НаО --- AggO + Zn + 2NaOH; Zn{OH)2 kgfi + Zn + H2O. 2Ag + NasZnO Аккумуляторы заряжаются под напряжением 2,1 в. Среднее разрядное напряжение 1,5 в. Наибольшая отдача аккумуляторов получается при зарядке в течение 10-20 ч, а при зарядке в течение 15- 20 мин отдача падает до 80%. Никель-цинковые (НЦ) аккумуляторы конструктивно почти не отличаются от СЦ и безламельных кадмиево-никелевых аккумуляторов. Положительным электродом служит высокопористая металлокерамическая основа (никелевая), пропитанная гидратом закиси никеля. Отрицательный электрод в виде брикета, спрессованного из смеси окиси цинка и связующего раствора, обернут несколькими слоями специального сорта целлофана. Электролитом служит раствор едкого кали с добавкой гидрата окиси лития. Химические реакции описываются уравнением: Zn + 2N{(OH) . Zn(OH)2 + 2Ni(OH)2. Серебряно-кадмиевые (9-8) герметизированные аккумуляторы малой емкости сочетают положительные свойства СЦ-аккумуляторов и конструктивные особенности кадмиево-никелевых герметизированных аккумуляторов. Положительным электродом служит одновалентная окись серебра; отрицательный электрод изготовляется из металлического кадмия. В качестве электролита применяется 40%-ный раствор едкого кали. Сепараторы изготовляются из целлофана. Благодаря малой растворимости окиси кадмия в щелочи образование дендридов кадмия и связанные с этим короткие замыкания электродов сквозь сепараторы почти исключены. Химические процессы во время заряда и разряда аккумулятора описываются уравнением: Cd + AgjO 2 Ag -I- CdO. (9-9) Эти аккумуляторы выдерживают до 3000 зарядно-разрядных циклов, хорошо сохраняются в течение длительного времени, обладают высокими значениями удельных характеристик. Специальные виды аккумуляторов могут быть самыми разнообразными. К ним относятся модернизированные известные аккумуляторы и новые. К специальным аккумуляторам можно отнести газовые, медно-цинковые, медно-никелевые, медно-свинцо-вые, серебряно-цинковые с высокой рабочей температурой, герметизированные никель-кадмиевые аккумуляторы с управляюш;им электродом и др. § 9-4. ТОПЛИВНЫЕ ЭЛЕМЕНТЫ Топливные элементы, название которых до последнего времени считается условным, обеспечивают непосредственное преобразование энергии химических реакций в электрическую энергию. Их действие основано на электрохимическом окислении топлива, т. е. на реакции, аналогичной горению топлива в тепловых машинах. Однако в отличие от тепловой машины в топливных элементах окисление топлива и восстановление кислорода происходит на разных электродах, отсутствует выделение большого количества тепла и энергия реакций выделяется в виде электрической энергии в нагрузке без промежуточных преобразований с большим коэффициентом использования топлива. В обычных электрохимических источниках тока в ходе окислительно-восстановительных процессов расходуются активные вещества электродов, а в топливных элементах электроды в реакциях активно не участвуют и не расходуются. Окислительно-восстановительные процессы в топливных элементах протекают при взаимодействии веществ, которые в газообразном и жидком виде непрерывно подводятся к электродам. Пока идет подача веществ, протекает их взаимодействие и электрическая энергия выделяется в полезной нагрузке. Топливные элементы принято разделять на три группы: с г а-зовым, твердым или жидким топливом и с ре-докс-системой. Возможна также их классификация по рабочему давлению и температуре. Элементы с рабочей температурой до + 250° С считаются низкотемпературными, до + КЮС С - высокотемпературными; при рабочем давлении до 5 атм их считают элементами низкого давления, а при давлении до 60 атм - элементами высокого давления. Как правило, у элементов с твердым топливом температура более высокая, чем в элементах с газовым топливом. Наиболее простыми и хорошо освоенными считаются водородно-кислородные топливные элементы. Схематическое устройство такого элемента показано на рис. 9-4, а. При протекании водорода и кислорода через патрубки в кожухе / сквозь пористые трубки 2, 3, находящиеся в щелочном электролите 4 (КОН), происходит разложение водорода на положительные иони ,.иы. Ионы водорода вступают в соединение с ионами гидроксила электролита и образуют воду Hfi в соответствии с уравнением Н^--НО (940) Отрицательные заряды (электроны), собирающиеся на трубке 2 (отрицательном электроде элемента), движутся по внешней цепи через сопротивление нагрузки 7? к электроду (трубке) 5, где они 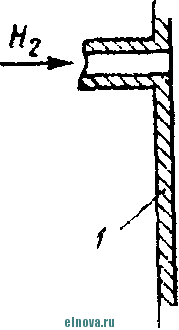  -НОИ - т  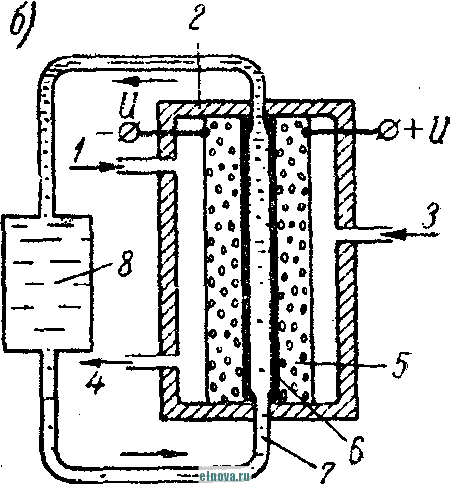 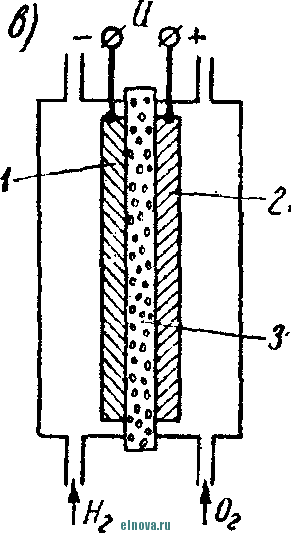 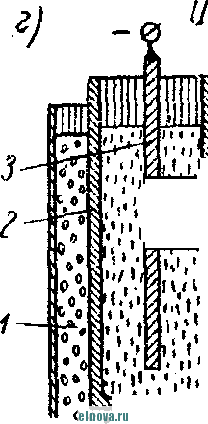  г 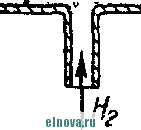 Регенерация натолита г .§1 -а Регенерация QHOnuma Phc. 9-4. Схематическое устройство топливных элементов. захватываются кислородом. В результате по сопротивлению на* грузки протекает электрический ток. Кислород, протекающий в пористой трубке 5, вступает тоже в реакцию с водой электролита, образуя гидроксильный остаток ОН. В результате кислород непрерывно пополняет в электролите расход гидроксила ОН, а водород поддерживает необходимое количество воды в электролите. Таким образом, описываемый процесс в топливном элементе как бы противоположен процессу электролитического разложения воды, когда при пропускании тока через подкисленную воду образуется кислород и водород. Описанный водородно-кислородный топливный элемент относится к низкотемпературным элементам, конструкции которых 1 ... 23 24 25 26 27 28 29 ... 32 |