
 | |
|
|
Главная » Книги и журналы 1 ... 22 23 24 25 26 27 28 ... 32 где Т и скважность импульса; п 1 + Kni 1 - Кш при скважности импульса 1, получим: 1п l + K (8-35) Зависимость отношения сунке показана зависимость от Kni показана на рис- 8-5, в- На этом же ри- ф (/Спу). Совмещение этих зависимостей воз- можно благодаря одинаковой структуре уравнении, как это видно из следующего. В момент окончания импульса тока в нагрузке (/ = t ) на конденсаторе минимальное напряжение и С ИНН Е \-irk т 1 -\-k и или п 1п т (гак как а CRn \ Следовательно, п 1 -\-k n(l i ш(1 - 1 1 +ft Для случая ft>>l, получим И In - In - /С (8-36) к Таким образом, при заданном значении k = RJRn пульсации тока и напряжения определяются выбором постоянных времени CR и С/? . При непосредственном определении величин RC и CRi на осювании заданных параметров импульса тока в нагрузке можно исходить из следующего. На основании приведенных соотношений 1п т п при <7 1 и й 1, получим п т 1п I -т (8-37) Зависимость - = ф (/С^\ показана на рис 8-5, г На основании приведенных соотношений можно также получить: к --(1 <7и 1п п 3- макс л, мин (I - п) In ..... т п In - п 1п 1 1 - /с /с (8-38) Можно показать на основании анализа действия емкостного накопителя в ре-зкиме частичного разряда, что при выборе величин коэффициептоз пульсагщи тока и напряжения, а также использования зарядного напряжения, целесообразно л. ма&с полагать: /С 3%, К,и 20% и п 0.9. При этом 3 макс 0.675: - 1015: 17: k = 0.15н, Энергетические соотношения в схеме накопителя получаются иа основании следующего. Средняя за период повторения импульса мoш^юcть в нагрузке 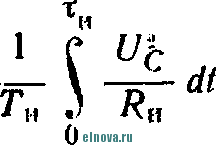 -л о где р Р и пч<: п vf 1 где Р„ - мощность в импульсе. Мощность постоянного тока, забираемая от источника заряда накопителя, - я. ср з-ср - среднее за период значение зарядного тока. При этом: 3. ср и Т О к Коэффициент полезного действия накопителя нак п 1 + /с„ Мошность, рассеивйемая в зарядном сопротивлении. Р рас 1 - л + п (8-39) (8-40). § 8-4. ИНДУКТИВНЫЙ НАКОПИТЕЛЬ ЭНЕРГИИ Схема индуктивного накопителя энергии во время его заряда показана на рис. 8-6, а. В промежутки времени от - О до / - = 7и~и^ когда сопротивление нагрузки бесконечно велико и ток 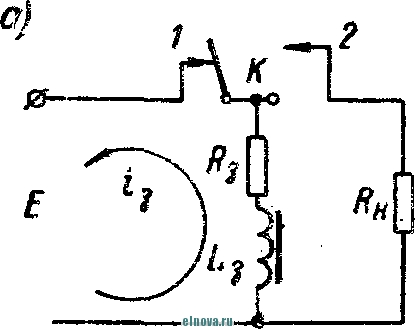 - & £ + 0- 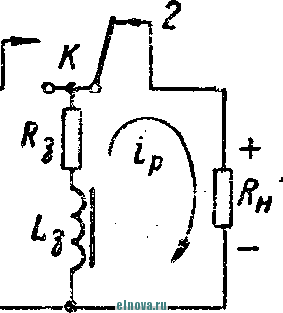 I 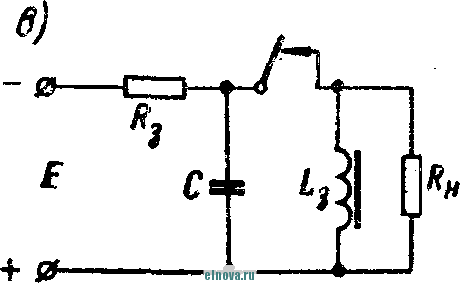 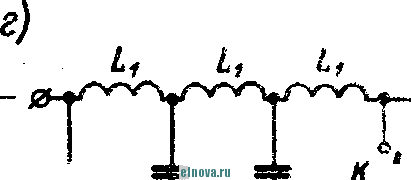  Рис. 8-6. Схема включения индуктивного накопителя энергии. через нагрузку не протекает, ключ К замкнут в положении, показанном на рис. 8-6, а, и происходит накопление энергии в магнитном поле индуктивности сопротивление является сопротивлением обмотки дросселя L3. Во время зарядки индуктивности Е = 13Дз Ь Z. Аз dt L, Следовательно, так как и dt; \nUi t + A; Ui = Ke Ha основании начальных условии можно определить постоянную интегрирования К и после соответствующих преобразований найти (8-41) Ко времени окончания заряда индуктивности, спустя 4 после начала заряда, ток в индуктивности достигает максимального значения - /ти. При этом в магнитном поле индуктивности будет запасена энергия £2 е 3 Энергия, теряемая в активном сопротивлении R ряда накопителя, за время за- пот 3 Л-1 3 / . о При переключении ключа К в положение 2 происходит разряд накопителя. Ток разряда сохраняет направление, каким оно было в индуктивности при заряде, и в результате этого на нагрузке создается полярность напряжения, показанная на рис. 8-6, б. По мере разрядки накопителя ток в нагрузке уменьшается по экспоненциальному закону, т. е. 3. макс .JL. -3 К. п. д. индуктивного накопителя определится в виде 1 1 2е Если --/з> 1 то Т]аак 2 3 f Рассеиваемая мощность в нагрузке Р и и 2т (8-42) и При заданной мощности в нагрузке требуемая индуктивность накопителя должна быть (8-43) На основании приведенных соотношении можно сделать вывод: индуктивный накопитель энергии в режиме полного разряда практически непригоден из-за чрезмерного искажения формы импульса тока в нагрузке. Такой накопитель энергии обеспечивает возможность питания нагрузки при низком питающем напряжении Индуктивный накопитель представляется рациональным сочетать с eMFcocTHbiM накопителем энергии по схеме рис. 8-6, е. В такой схеме ток, забираемый от источника питания, уменьшается в TJt раз. Исправление формы импульса тока в нагрузке может быть достигнуто при использовании распределенной индуктивности ко-роткозамкнутой линии в схеме накопителя (рис. 8-6, г). В накопителе по схеме рис. 8-6, г заряд происходит при замкнутом ключе. Если к моменту размыкания ключа /< ток в линии достигнет величины 2/ши, то при замыкании линии на нагрузку  произойдет разряд ЛИНИИ И в нагрузке поддерживается ток /;пв на время t , равное удвоенному времени пробега электромагнитной волны вдоль линии. Если ключом повторью замкнуть линию накоротко до того, как она полностью разрядится, произойдет частичный разряд накопителя и его последующий подзаряд. Такой режим работы идентичен с режимом работы емкостного накопителя с частичным разрядом. Форма импульса тока в нагрузке при частичном разряде индуктивного накопителя искажена, так как в начале импульса тока нагрузки ток разряда больше, чем в начале разряда. § 8-5, СОВМЕЩЕНИЕ ФУНКЦИЙ НАКОПИТЕЛЯ И СГЛАЖИВАЮЩЕГО ФИЛЬТРА При работе выпрямителя со сглаживающим фильтром на нагрузку импульсного характера конденсатор фильтра Сф (рис. 8-7, а) может рассматриваться как своеобразный емкостный накопитель, который одновременно выполняет функции сглаживания пульсаций при работе выпрямителя на непрерывную нагрузку. Искажения формы импульса тока в нагрузке можно определить на основании обозначений рис. 8-7, б в виде: Ль м акс и. мин (8-44) где токи / , акс и /и. мин соответству!. и минимальному значениям напряжений на коиденс^шрс в начале и конце импульса, полагая, что сопротивление нагрузки - неизменной величинь!. 6} ii 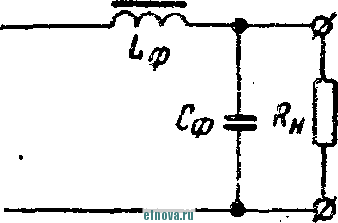 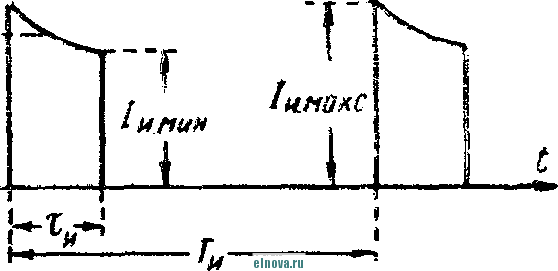 Рис- 8-7. К расчету емкости сглаживающего фильтра при питании нагрузки импульсного характера в таком случае, полагая напряжение на конденсаторе изменя- ющимся по закону получим: Если задана величина /(и, то требуемая емкость фильтра (845) Такое определение величины емкости фильтра возможно при  2л ф Весь дальнейший расчет фильтра может быть выполнен так, как описано в § 6-2. ГЛАВА ДЕВЯТАЯ ЭЛЕКТРОХИМИЧЕСКИЕ ИСТОЧНИКИ ТОКА И НЕПОСРЕДСТВЕННЫЕ ПРЕОБРАЖ)ВАТЕЛИ ЭНЕРГИИ § 9-1. ОБЩИЕ СВЕДЕНИЯ К электрохимическим источникам тока относятся в первую очередь электрохимические элементы и аккумуляторы. По общности характера протекаемых процессов электрохимическими источни- 1 - л. . . ками тока являются также топливные и биологические элементы которые ниже условно отнесены к непосредственным преобразователям энергии. Электрохимические источники разделяются на первичные и вторичные источники тока. К первым относятся элементы, ко вторым - аккумуляторы. В первичных электрохимических источниках тока энергия образуется непосредственно благодаря химическому взаимодействию входящих в них активных веществ. Такие источники тока, например элементы, отдают электрическую энергию в нагрузку без предварительного сообщения им электрической энергии от постоянного источника тока. В элементах происходит необратимый электрохимический процесс, связанный с переходом валентных электронов с одного вещества (электрода) к другому веществу. При этом вещество одного электрода расходуется, так как переход электронов сопряжен с процессом вытеснения одного металла другим. В результате израсходования вещества одного из электродов элемент перестает действовать. Такие элементы называются источниками тока одноразового использования. Аккумуляторы являются вторичными электрохимическими источниками тока. Они служат для накапливания электрической энергии при зарядке, а расходование йакопленной энергии осуществляется практически при их разрядке на нагрузку. Электрохимические процессы в аккумуляторах обратимы и их можно использовать как источники тока много раз. Непосредственными преобразователями э н е р г иипринято называть такие, в которых происходит преобразование первичной энергии (тепловой, энергии солнечной радиации и радиоактивного излучения, энергии электрического поля и т. п.) в электрическую энергию. Такими непосредственными преобразователями энергии являются термоэлектрогенераторы, солнечные и атомные батареи и другие подобные устройства. Во всех этих преобразователях исключены промежуточные преобразования энергии. § 9-2. ЭЛЕКТРОХИМИЧЕСКИЕ ЭЛЕМЕНТЫ И БАТАРЕИ В электрохимических элементах одновременно протекают окислительные и восстановительные электрохимические процессы. В простейшем случае процесс окисления сводится к тому, что атом или молекула отдают электрон и становятся положительным ионом. Если в процессе окисления отрицательный ион (атом с избытком электронов) отдает часть своих электронов, то ои может стать либо нейтральным атомом, либо положительным ионом. Процесс восстановления сводится к присоединению электронов атомом или молекулой. Этот процесс, как и окислительный, сопровождается изменением свойств и заряда молекул и атомов. Окислительно-восстановительные ..лскают одновре- менно: на одном электроде - процесс окисления, в то время как на другом электроде элемента - процесс восстановления. Оба процесса не только происходят одновременно, но и связаны между собой. Причем окислительно-восстановительные процессы могут быть в одном случае обратимы, а в другом случае - необратимыми . {ДЯ выравнивания концентрации валентных электронов вещества электродов необходим электролит, в котором осуществляется растворение электродов. Поскольку разные металлы растворяются в электролитах по-разному, то каждый металл, погруженный в электролит, создает строго определенный потенциал в гальванической паре металл - электролит. Такой потенциал принято называть нормальным электродным потенциалом, возникающим при погружении металла в раствор, один литр которого содержит грамм-ион этого же металла в форме простой соли. Таким образом, простейшим электрохимическим элементом является элемент, состоящий из двух электродов и электролита. В ре-зультате действия этого элемента создается э. д. с, равная раз-кости нормальных электродных потенциалов. Величина э. д. с. не зависит от формы и размеров электродов. Часто значение э. д. с. элемента выражают в виде: e=e, -зл, , (9-!) где 0 - разность потенциалов между электролитом и электродом, не растворяющимся в электролите; e - разность потенциалов между электролитом и электродом, растворяющимся в электролите. Например, у медно-цинкового элемента во = + 0,34 в, эл = = - 0,76 в, е = + 0,34 ~ (- 0,76) - 1,1 е. В окислительно-восстановительных процессах, связанных с растворением металлов, в электролите появляются побочные хихмнче-ские продукты, чаще всего водород. Его выделение будет тем большим, чем интенсивнее протекают окислительно-восстановительные процессы. Кроме основных гальванических пар электродов с электролитом создается промежуточная пара металл - водород, э. д. с. которой имеет полярность, противоположную полярности э. д. с. элемента. В результате суммарная э. д. с. элемента понижается. Процесс возникновения гальванической пары металл - водород принято называть поляризацией элемента. Для нормальной работы элемента необходим деполяризатор, действие которого сводится, в основном, к связыванию выделяющегося водорода. В качестве деполяризаторов применяются различные окислители, богатые кислородом, который может удержать {связать) выделяющийся водород. Наиболее распространенным деполяризатором служит двуокись марганца. Очевидно, что электрохимические элементы отличаются между собой веществом электродов, электролитом и деполяризатором. Выбор электрохимической пары (электродов и электролита), а также деполяризатора, предопределяет параметры и эксплуатационные свойства элементов. 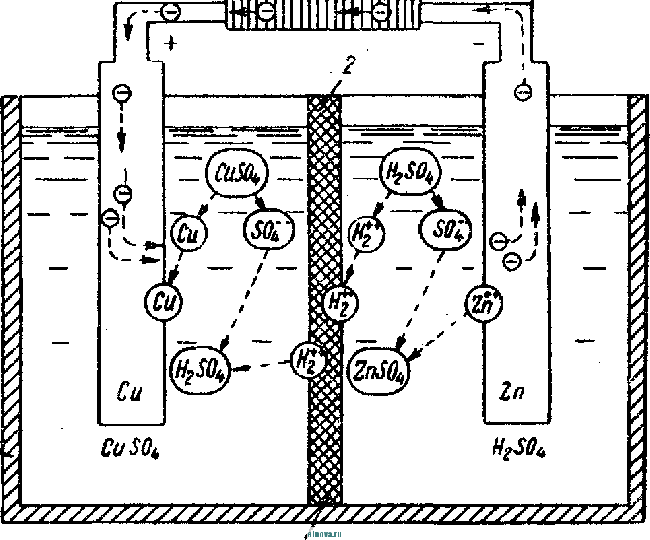  Рис. 9-1. Схематическое устройство медно-цинкового элемента (а) и внешний вид элементов и батарей различных конструкций (б). Для конкретизации хода окислительно-восстановительных процессов может быть рассмотрено схематическое устройство медно-цинкового элемента с жидким электролитом. Схематическое устройство такого элемента показано на рис 9-1, л. Элемент имеет конструкцию стаканчика и состоит из стеклянного сосуда /, разделенного на две части перегородкой 2 из пористой (необожженной) глины. В ле* 999995 вой части сосуда содержится насыщенны, уии купороса CUSO4, в который погружен медный электрод, являющийся положительным электродом элемента (+); в правой части сосуда налит раствор серной кислоты H2SO4 с погруженным в него цинковым электродом, являющимся отрицательным (-) электродом элемента. При разомкнутой внешней цепи элемента обмен между электродами электрическими зарядами почти исключен- Ионы, перешедшие с электродов в раствор, располагаются вблизи границы раздела металл - раствор и образуют двойной электрический слой. В этом слое начинают накапливаться заряды, п разность потенциалов электрода и электролита возрастает настолько быстро, что переход ионов прекращается, причем количество перенесенного ионами металла ничтожно мало- При замкнутой внешней цепи элемента по сопротивлению нагрузки протекает ток. При этом происходит растворение цинкового электрода и образуются все новые порции раствора сернокислого цинка ZnS04, а на медном электроде осаждается медь из раствора медного купороса CUSO4. Этот процесс обусловлен тем, что у ионов цинка стремление перейти в раствор больше, чем у ионов меди, ввиду разной концентрации валентных электронов в этих металлах. В результате цинковый электрод заряжается отрицательно, а медный - положительно При этом состояние равновесия, установившееся было благодаря наличию двойного электрического слоя, нарушается и электроны с цинкового электрода перемещаются по внешней цепи элемента к медному элеюроду. Восстановление нарушенного равновесия создается благодаря тому, что металлический иинк переходит в раствор в виде иоков, а электрическая нейтрализация электролита сохраняется за счет движения ионов водорода сквозь пористую перегородку 2 к положительному электроду. Одновременно с этим приходящие из внешней цепи электроны нейтрализуют у положительного электрода ионы меди, которые оседают ка медном электроде. Таким образом, в результате окислительно-восстановите*1ьного процесса в элементе с замкнутой внешней цепью происходит непрерывное растворение цинкового электрода, сопровождающееся увеличением объема медного электрода. Кислотность электролита у отрицательного электрода уменьшается, а у положительного электрода увеличивается: концентрация медного купороса понижается, концентрация раствора цинкового купороса повышается. Поляризация и деполяризация в медно-цинкозом элементе сводится к следую-шему. В процессе длительной разрядки наступает истощение раствора медного купороса н число ионов, участвующих в реакции, становится ?!едостаточным. В результате этого ионы водорода направляются к полоисительному электроду и разряжаются на нем. Образующийся при этом cвoбoдгый водород растворяется в поверхностном слое электрода и изменяет его потенциал относительно электролита. Baiccto медного электрода как бы создается водородный электрод с пониженным потенциалом. При этом становится ощутимым процесс поляризации, сказывающийся в уменьшении э. д. а элемента, причем действие поляризации прогрессирует с увеличением разрядного тока, Если элемент разряжается небольшим током, то часть образующегося водорода успевает выделиться в окружающую среду в виде пузырьков к процесс поляризации проявляется менее заметно, чем при разряде большим током. Этим объясняется характер изменения э. д. с. элементов при различных режимах разряда. описываемом медно-цинковом элементе своеобразным деполяризатором является медный купорос. Практически используются и другие виды деполяризаторов. В разных типах элементов может быть применен различный электролит. Наиболее распространенные элементы с угольно-мар-ганцево-цинковой системой (уголь и цинк - электроды, марганец - деполяризатор) наполняются жидким электролитом, в качестве которого служит 15%-ный водный раствор аммиака. 1 ... 22 23 24 25 26 27 28 ... 32 |